重庆市南开中学2016届二模理科综合试题及答案(2)

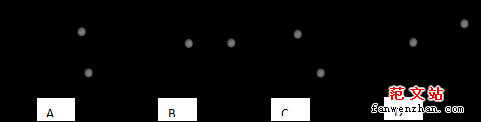
15.两根长度不同的细线下面分别悬挂两个小球,细线上端固定在同一点,若两
个小球以相同的角速度,绕共同的竖直轴在水平面内做匀速圆周运动,则两个摆球在运动过程中,相对位置关系示意图正确的是
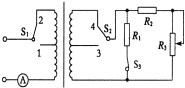 16.如图所示,理想变压器初级线圈接一正弦式交变电流,交变电流的电压有效值恒定不变.则
16.如图所示,理想变压器初级线圈接一正弦式交变电流,交变电流的电压有效值恒定不变.则
下列说法中正确的是
A.只将S1从2拨向1时,电流表示数变小
B.只将S2从4拨向3时,电流表示数变大
C.只将S3从闭合变为断开,电阻R2两端电压不变
D.只将变阻器R3的滑动触头上移,变压器的输入功率增大
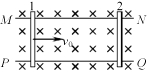
17.如图所示,在水平面上有两条平行金属导轨MN、PQ,导轨间距为d,匀强磁场垂直于导轨所在的平面向下,磁感应强度大小为B,两根金属杆间隔一定的距离摆放在导轨上,且与导轨垂直,两金属杆的质量均为m,有效电阻均为R,两杆与导轨接触良好,导轨电阻不计,金属杆与导轨间的摩擦不计,现将杆2固定,杆1以初速度v0滑向杆2。为使两杆不相碰,两杆初始间距至少为
A.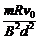 B.
B. C.
C. D.
D.
 18.如图所示,以直角三角形AOC为边界的有界匀强磁场区域,磁感应强度为B,∠A=60°,AO=L,在O点放置一个粒子源,可以向各个方向发射某种带负电粒子(不计重力作用),粒子的比荷
18.如图所示,以直角三角形AOC为边界的有界匀强磁场区域,磁感应强度为B,∠A=60°,AO=L,在O点放置一个粒子源,可以向各个方向发射某种带负电粒子(不计重力作用),粒子的比荷 ,发射速度大小都为v0,且满足
,发射速度大小都为v0,且满足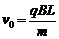 粒子发射方向与OC边的夹角为θ,对于粒子进入磁场后的运动,下列说法正确的是
粒子发射方向与OC边的夹角为θ,对于粒子进入磁场后的运动,下列说法正确的是
A.粒子不可能打到A点
B.以θ=60°飞入的粒子在磁场中运动时间最短
C.以θ<30°飞入的粒子在磁场中运动的时间都相等
 D.在AC边界上只有一半区域有粒子射出
D.在AC边界上只有一半区域有粒子射出
19.如图所示,四个等量异种电荷,放在正方形的四个顶点处,A、B、C、D为正方形四个边的中点,O为正方形的中心.下列说法中正确的是
A.A、C两点的电场强度相同,B、D两点电势相同
B.D点电势、场强均为零
C.将一带负电的试探电荷从B点沿直线移动到D点,所受电场力先减小后增大
D.将一带正电的试探电荷从A点沿直线移动到C点,试探电荷具有的电势能先增大后减小
20.一宇航员到达半径为R、密度均匀的某星球表面,做如下实验:用不可伸长的轻绳拴一质量为m的小球,上端固定在O点,如图甲所示,在最低点给小球某一初速度,使其绕O点的竖直面内做圆周运动,测得绳的拉力F大小随时间t的变化规律如图乙所示.F1=7F2,设R、m、引力常量G以及F1为已知量,忽略各种阻力.以下说法正确的是
 A.该星球表面的重力加速度为
A.该星球表面的重力加速度为
B.卫星绕该星球的第一宇宙速度为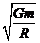
C.星球的质量为
D.小球在最高点的速度为零
21.如图所示,小物块以初速度v0从O点沿斜面向上运动,同时从O点斜向上抛出一个速度大小也为v0的小球,物块和小球在斜面上的P点相遇.已知物块和小球质量相等,空气阻力忽略不计,则
 A.斜面可能是光滑的
A.斜面可能是光滑的
B.在P点时,小球的动能大于物块的动能
C.小球运动到距水平地面最高处时离斜面最远
D.小球和物块到达P点过程中克服重力做功的平均功率相等
第II卷
 二.非选择题:包括必考题和选考题两部分。第22题—第32题为必考题,每个考题考生都必须作答,第33~40为选考题,考生根据要求作答。
二.非选择题:包括必考题和选考题两部分。第22题—第32题为必考题,每个考题考生都必须作答,第33~40为选考题,考生根据要求作答。
(一)必考题(共129分)
22.(6分)某实验小组采用如图甲所示的装置研究“小车运动变化规律”,打点计时器工作频率为50Hz.
实验的部分步骤如下:
a.将木板的左端垫起,以平衡小车的摩擦力;
b.在小车中放入砝码,以确保小车及车中砝码总质量远大
于钩码质量,纸带穿过打点计时器,连在小车后端,用细线
连接小车和钩码;
c.将小车停在打点计时器附近,接通电源,释放小车,小车拖动纸带,打点计时器在纸带上打下一系列的点,断开电源;
d.改变钩码或小车中砝码的质量,更换纸带,重复b、c的操作
(1)设钩码质量为m1、砝码和小车总质量为m2,重力加速度为g,则小车的加速度为:a=____(用题中所给字母表示);
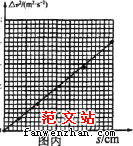 (2)下图是某次实验中得到的一条纸带如图乙所示,在纸带上以相同的时间间隔取计数点O、A、B、C、D和E,读出各计数点对应的刻度x,通过计算得到各计数点到O的距离s以及对应时刻小车的瞬时速度v,该实验小组绘制出△v2-s图线如图丙示,来分析运动规律(其中△v2=-v2-v02,v是各计数点对应时刻小车的瞬时速度,v0是O点对应时刻小车的瞬时速度)。则,△v2-s图线的斜率k=_____(用题中所给字母表示),若发现该斜率大于理论值,其原因可能是_______________
(2)下图是某次实验中得到的一条纸带如图乙所示,在纸带上以相同的时间间隔取计数点O、A、B、C、D和E,读出各计数点对应的刻度x,通过计算得到各计数点到O的距离s以及对应时刻小车的瞬时速度v,该实验小组绘制出△v2-s图线如图丙示,来分析运动规律(其中△v2=-v2-v02,v是各计数点对应时刻小车的瞬时速度,v0是O点对应时刻小车的瞬时速度)。则,△v2-s图线的斜率k=_____(用题中所给字母表示),若发现该斜率大于理论值,其原因可能是_______________
23.(10分)测量电源的电动势和内阻,提供的器材如下:
 A.待测电源(电动势约为8V、内阻约为2Ω)
A.待测电源(电动势约为8V、内阻约为2Ω)
B.电压表V(0-3V,内阻约为3kΩ)
C.电流表A(0-1,内阻约为1Ω)
D.电阻箱R(0-99999.9Ω)
E.滑动变阻器(0-20Ω)
F.滑动变阻器(0-1000Ω)
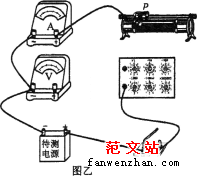 G.开关、导线若干
G.开关、导线若干
(1)为扩大电压表的量程,现采用图甲所示电路测量电压表的内阻Rv.调节电阻箱R,使电压表指针满偏,此时电阻箱示数为R1.再调节电阻箱R,使电压表指针指在满刻度的一半处,此时电阻箱示数为R2.则电压表内阻Rv=_______.
(2)若测得电压表内阻Rv=3010Ω,与之串联R=______Ω的电阻,将电压表的量程变为9V。
(3)为测量电源的电动势和内阻,请用笔画线代替导线,将图乙电路连接完整。实验中,滑动变阻器应选择______(选填“E”或“F”),并指出产生实验误差的一个原因(写出一点):___________________
 24.(12分)如图,在倾角为θ=37°的足够长的固定斜面底端,一小物块以某一初速度沿斜面上滑,一段时间后返回到出发点。若物块上滑所用时间t1和下滑所用时间t2的大小关系满足t1:t2=
24.(12分)如图,在倾角为θ=37°的足够长的固定斜面底端,一小物块以某一初速度沿斜面上滑,一段时间后返回到出发点。若物块上滑所用时间t1和下滑所用时间t2的大小关系满足t1:t2=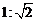 ,取g=10m/s2,sin37°=0.6,cos37°=0.8,试求:
,取g=10m/s2,sin37°=0.6,cos37°=0.8,试求:
(1)物块和斜面之间的动摩擦因数;
(2)若斜面倾角变为60°,并改变斜面粗糙程度,小物块上滑的同时用水平向右的推力F作用在物块上,发现物块匀减速上滑过程中加速度与推力大小无关,求此时加速度大小.
25.(19分)如图甲所示,Y轴右侧空间有垂直xoy平面向里的匀强磁场,同时还有沿﹣y方向的匀强电场(图中电场未画出).磁感应强度随时间变化规律如图乙所示.t=0时刻,一质量为m、电荷量为+q的带电粒子以速度v0从坐标原点O沿x轴射入电场和磁场区,t0时刻粒子到达坐标为(x0y0)的点A(x0>y0),速度大小为v,方向沿+x方向,此时撤去电场.t=t0+t1+t2时刻,粒子经过x轴上x=x0。点,速度沿+x方向.不计粒子重力,上述m、q、v0、v、x0、y0、B0为己知量,求:
(1)0-t0时间内OA两点间电势差UOA;
(2)粒子在t=0时刻的加速度大小a0;
(3)B1的最小值及对应t2的表达式.
26.(14分)钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,只有最后一步钨的化合价改变。
③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为______,请写出MnWO4在熔融条件下发生碱分解反应的化学方程式____________________________________________________________________。
 (2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子含有SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为________________, 滤渣II的主要成分是_____________________
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子含有SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为________________, 滤渣II的主要成分是_____________________
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。右图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
①T1______T2(填“>”或“<”);
②T1时Ksp(CaWO4)=_____mol·L-1。将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为____________,T2时该反应的平衡常数为_______mol·L-1。
 27.(14分)碳酸亚铁(FeCO3)是菱铁矿的主要成分,将其在空气中高温煅烧能生成Fe2O3。再将Fe2O3在一定条件下还原可得“纳米级”的金属铁,而“纳米级”的金属铁则可用于制造固体催化剂。
27.(14分)碳酸亚铁(FeCO3)是菱铁矿的主要成分,将其在空气中高温煅烧能生成Fe2O3。再将Fe2O3在一定条件下还原可得“纳米级”的金属铁,而“纳米级”的金属铁则可用于制造固体催化剂。
(1)已知25℃,101kPa时:
①CO2(g)=C(s)+O2(g) △H=+393kJ·mol-1
②铁及其化合物反应的焓变示意图如右图:
请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式_______________________________________。
(2)一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H
①该反应的平衡常数K的表达式为________________________。
 ②该反应在3L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g,则该段时间内用H2表示该反应的平均反应速率为________________________。
②该反应在3L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g,则该段时间内用H2表示该反应的平均反应速率为________________________。
③在容积均为VL的I、II、III三个相同密闭容器中加入足量Fe2O3,然后分别充入a mol CH4,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、II、III三个容器中一定处于化学平衡状态的是________;上述反应的△H____0(填“大于”或“小于”)。
(3)还原的铁通过对N2、H2吸附和解吸可作为合成氨的固体催化剂。若用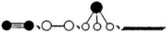 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:

 ①吸附后,能量状态最低的是________(填字母序号)。
①吸附后,能量状态最低的是________(填字母序号)。
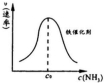
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系
如图。从吸附和解吸过程分析,c0前速率增加的原因可能是____________;
c0后速率降低的原因可能是__________。
28.(15分)水合肼(N2H4·H2O)又名水合联氨,是无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
 实验一:制备NaClO溶液。(实验装置如右图所示)
实验一:制备NaClO溶液。(实验装置如右图所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是________________________。
(3)设计实验方案:用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度(实验提供的试剂:
 H2O2溶液、FeCl2溶液、0.10mol·L-1盐酸、酚酞试液):________(不必描述操作过程的细节)。
H2O2溶液、FeCl2溶液、0.10mol·L-1盐酸、酚酞试液):________(不必描述操作过程的细节)。
实验二:制取水合肼。(实验装置如右图所示)
(4)装置A的名称为__________,①反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
- 上一篇:2016山东青岛理综一模试题及答案
- 下一篇:2016年高考理综模拟试题